郭方课题组在《Neuron》发文揭示节律神经回路参与睡眠觉醒的调控机制
2018年9月27日,mgm美高梅79906神经科学中心郭方课题组在《Neuron》上在线发表了题为《A Circadian Output Circuit Controls Sleep-Wake Arousal in Drosophila》的研究论文。该研究鉴定出果蝇的背侧节律神经元APDN1往果蝇的睡眠稳态中心,椭球体EB-R2投射的神经回路,揭示了该神经回路决定睡眠和觉醒水平(Arousal Level)的作用机制,研究结果为阐述昼夜节律回路(Circadian circuit)和睡眠回路的连接机制提供了非常重要的实验依据。

昼夜节律和睡眠是共同进化而来的生物现象,在果蝇,小鼠和人类中,都能观察到这两种相互偶联的行为。近年来对各种模式生物的研究,让我们对分别调控这两种行为的分子和神经通路了解得很多。 但在大多数生物中,对节律神经回路如何输出到睡眠中心的连接机制依然未知。使得这成为睡眠领域的一个非常重要的问题。
在这些模式生物中,果蝇无疑是最重要的一个,对其生物钟的研究获得了2017年的诺贝尔生理学和医学奖(本篇论文的通讯作者之一Michael Rosbash教授是获奖者)。在果蝇脑中,约有75对节律神经元组成的神经回路,指导着果蝇在不同的时间点有序的进行各种行为,例如进食,运动,睡眠和觉醒等。同时,果蝇中调控觉醒水平(Arousal level)和睡眠稳态的神经回路也已经被定位到椭球体EB-R2中[1, 2]。那么,这两套神经回路是如何共同作用来决定果蝇的睡眠觉醒状态的呢?
研究发现,果蝇节律神经回路包含不同的神经元亚群。其中促进睡眠的是一小簇背部神经元(APDNs),它们有着独特的投射模式(projection patterns),其往后侧投射的轴突能抑制促进活动(activity-promoting)的节律神经元LNds[3]。而往前的轴突则投射到一个叫AOTU的脑区。在这里,它们支配着一群特殊的TuBu神经元,并通过其与更高脑区域的睡眠稳态中心-椭球体EB-R2偶联。值得注意的是,激活APDN会在EB-R2中产生类似睡眠时的特定振荡模式。光遗传学提供的行为学证据进一步表明,该APDNs-TuBu-EB神经回路参与调节果蝇的睡眠和觉醒水平。
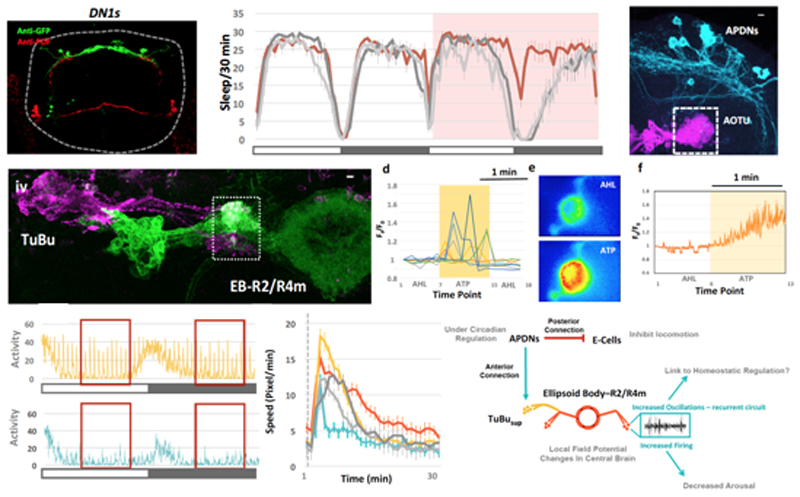
这项研究为揭示睡眠之谜提供了重要的启示。众所周知,不同动物的睡眠都能呈现出相同的特征,例如:减少和停止运动,降低觉醒(Arousal)从而抑制对外界刺激的反应,相关脑区的神经元呈现出特定的振荡模式,以及能被体内的生物钟调控等等。令人惊讶的是,这些特征均能被从节律神经元输出到睡眠稳态中心的连接回路所调节,虽然目前对具体的作用机理还不甚清楚,但毫无疑问,果蝇作为简单而复杂的模式生物,它的丰富的遗传学工具,能帮助我们进一步揭秘睡眠调控的保守的信号通路和神经机制。
《Neuron》的匿名评审专家们对这一研究结果也评价到:“该论文提供了(果蝇)生物钟和睡眠调节之间目前最全面的联系,并为理解高度保守的睡眠和昼夜节律整合的神经机制提供了平台。研究中应用了最先进的遗传工具和实验技术来绘制神经回路。”“该论文使用多种先进的技术组合提供了令人信服的证据,证明了将昼夜节律神经元连接到睡眠中心的神经回路及其功能““这一研究将对该领域产生巨大影响”。
mgm美高梅79906神经生物系的郭方研究员为论文的第一作者,郭方研究员和美国Brandeis大学的Michael Rosbash教授为本论文的共同通讯作者。mgm美高梅79906为第一作者单位。
目前课题组正在招聘技术员和博士后,欢迎神经领域的有志之士和郭方研究员联系(email:gfang@zju.edu.cn)。
1. Lebestky, T., et al., Two different forms of arousal in Drosophila are oppositely regulated by the dopamine D1 receptor ortholog DopR via distinct neural circuits. Neuron, 2009. 64(4): p. 522-36.
2. Liu, S., et al., Sleep Drive Is Encoded by Neural Plastic Changes in a Dedicated Circuit. Cell, 2016. 165(6): p. 1347-1360.
3. Guo, F., et al., Circadian neuron feedback controls the Drosophila sleep--activity profile. Nature, 2016. 536(7616): p. 292-7.